المادّة
المادّة (بالإنجليزيّة: Matter) هي كلّ ما يحيط بالإنسانَ؛ سواءً كان ملموساً أو غير ملموسٍ، ولكن يمكن إدراكها والتعرّف عليها؛ فلها كثافة وكتلة وشكل، وتتكوّن من أجسامٍ صغيرةٍ جداً تُسمّى ذرّاتٍ (بالإنجليزيّة: Atoms)، لا تُرى بالعين المُجرَّدة، بل بالفحص المخبريّ. تتكوّن المادّة من نوعٍ واحدٍ من العناصر (بالإنجليزيّة: Elements)، أو اتّحاد أكثر من عنصرٍ مكوّنةً المركّب (بالإنجليزيّة: Compound)؛ حيث تكوّن العناصر بدورها من ذرّاتٍ وحيدةٍ، أو جزيئاتٍ (بالإنجليزيّة: Molecules)؛ ناتجةٍ عن اتّحاد أكثر من ذرّةٍ.[١]
حالات المادّة
تُقسَم المادّة حسب الحالة الفيزيائيّة التي توجَد فيها إلى:[٢]
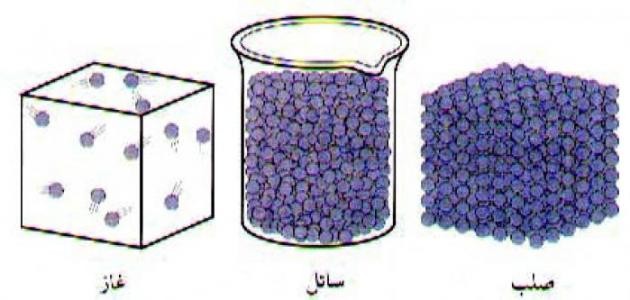
- الحالة الصّلبة (بالإنجليزيّة: Solid State):هي الحالة التي تكون مكوّنات المادّة فيها قريبةً جداً، ومترابطةً فيما بينها؛ بحيث تكون قوّة الترابط الموجودة بين الذرّات أو الجزيئات كبيرةً جداً، ولا يمكن تحريكها بسهولةٍ، ويكون للمادّة في هذه الحالة شكل معيّن لا يمكن تغييره بسهولةٍ إلا تحت ظروفٍ معيّنةٍ، مثل: الحجارة، والأخشاب، ومن الجدير بالذّكر أنّ ذرّات المادّة الصّلبة تهتزّ وتتحرّك باستمرارٍ، ولكن ليس من الممكن رؤية هذه الحركة.
- الحالة السّائلة (بالإنجليزيّة: Liquid State):هي الحالة التي تكون مكوّنات المادّة فيها أقلّ تماسكاً من الحالة الصّلبة؛ وذلك بسبب قدرة الذرّات على الحركة بسهولةٍ في الوسط؛ نتيجة ضعف قوّة التّرابط بينها. وتتميّز السّوائل بعدم وجود شكلٍ ثابتٍ لها؛ حيث تتّخذ شكل الوعاء الذي توجد فيه، كما إنّ لكلِّ سائلٍ لزوجةً مختلفةً عن غيره من السّوائل.
- الحالة الغازيّة (بالإنجليزيّة: Gaseous State):هي الحالة التي تتحرّك الذرّات فيها حركةً عشوائيّةً، وبحريّةٍ تامّةٍ، وتتميّز الغازات بأنّها لا تملك شكلاً وحجماً مثل المادّتين الصّلبة أو السّائلة، ولكن يمكن ضغطها في وعاءٍ، مثل: البالونات، والإطارات، وغيرها.
- البلازما (بالإنجليزيّة: Plasma state):هي غازات متأيّنة مثل الغازات التي تُنتِج البرق، أو تلك الموجودة على سطح الشّمس، وهي عبارةٌ عن مادّة تكون الإلكترونات فيها حرّةً غير مرتبطةٍ بالبروتونات والنّيوترونات، وتحدث حالة البلازما عند تعريض الغاز إلى حرارةٍ وطاقةٍ مُحدّدتين، تؤدّيان إلى خروج إلكترون أو أكثر منه.
كيفيّة قياس المادّة
قياس كتلة المادّة ووزنها
تُعرَّف الكتلة (بالإنجليزيّة: Mass) بأنّها مقدار فيزيائيّ يعبّر عن كميّة المادّة الموجودة في جسمٍ محدَّدٍ، وتُقاس بالكيلوغرام حسب النّظام العالميّ للوحدات، أمّا الوزن (بالإنجليزيّة: Weight) فهو مقدار جاذبيّة الأرض للجسم، كما عرّفها العالِم الفيزيائيّ المعروف نيوتن، وبهذا تُعدّ كتلة المادّة مقداراً ثابتاً لكميّةِ محدّدةٍ منها، أمّا الوزن فهو مقدار متغيّر؛ حسب موقع هذه المادّة.[٣]
تُقاس كتلة المادّة ووزنها بالاعتماد على عدّة أدواتٍ تختلف فيما بينها؛ حسب الدقّة والسّعة، ومن الأدوات المشهورة المُستخدَمة في قياس الكتلة الميزان ثلاثيّ الأذرع، أمّا الوزن فيُقاس بعدّة موازين، ومنها الميزان الزّنبركيّ؛ حيث يُحدِّد مقدار التمدُّد في السّلك الزنبركيّ وزنَ المادّة.[٣]والقانون الآتي يربط كلّاً من الوزن والكتلة معاً:[٤]
- الوزن=الكتلة×تسارع جاذبيّة الكرة الأرضيّة
ملاحظة:مقدار تسارع الجاذبيّة الأرضيّة ثابت، ويساوي 9.8م/ث².
قياس حجم المادّة
حجم المادّة (بالإنجليزيّة: Volume) هو المقدار الذي يعبّر عن الحيز الذي تشغله المادّة في الفراغ، ويُقاس بالمتر المكعّب حسب النّظام العالميّ للوحدات. يُقاس حجم المادّة مخبريّاً في حال كانت المادّة سائلةً باستخدام المخبار المُدرَّج أو الكوب المُدرَّج، في حين يُقاس حجم الجسم ذي الشكل المُنتظَم بالاعتماد على قوانين رياضيّةٍ مُحدَّدةٍ، وفي حال كان الجسم غير منتظمٍ فإنّه لا يمكن قياس حجمه، إلا إن كان صغيراً، وذلك بوضعه في ماءٍ معلوم الحجم، وحساب الزّيادة في الحجم بعد غمسه فيه، فيكون الفرق بين الحجم قبل وضع الجسم وبعده هو قياس حجم الجسم.[٣]
قياس كثافة المادّة
كثافة المادّة (بالإنجليزيّة: Density) هي مقدار تركيز المادّة في الحجم الذي يشغله الجسم، ومن الجدير بالذّكر أنّ كتلة المادّة وحجمها وكثافتها مقاديرُ مرتبطةٌ ببعضها، وتُقاس حسب القانون الآتي:[٥]
- كثافة المادّة=الكتلة/الحجم
ويُعبَّر عن الكثافة بوحدة كغ/م³، حسب النّظام العالميّ للوحدات.
قياس الكتلة الذريّة
الكتلة الذريّة (بالإنجليزيّة: Atomic Mass) هي مجموع كلٍّ من البروتونات والنّيوترونات الموجودة في نواة الذرّة، وتُقاس الكتلة الذريّة لمادّةٍ معيّنةٍ نسبيّاً حسب الكتلة الذريّة لنظير الكربون 12؛ حيث تساوي وحدة الكتلة الذرية 12/1 من كتلة ذرّة الكربون 12، وتُحسَب الكتلة الذريّة كما يأتي:[٥]
- الكتلة الذريّة لذرّةٍ محدّدة=(12/1)×(كتلة ذرّة العنصر/كتلة ذرّة نظير الكربون12)
أمّا معدّل الكتلة الذريّة فهو عبارةٌ عن الكتلة الذريّة للعنصر عند وجود أكثر من نظيرٍ له، وهي القيمة التي تكون موجودةً في الجدول الدوريّ للعناصر، وتُحسَب بشكل عامٍ كما يأتي:[٥]
- معدّل الكتلة الذريّة=(كتلة النظير الأوّل×نسبة وجوده+كتلة النّظير الثاني×نسبة وجوده)/100
قياس عدد المولات
يُعرَّف المول (بالإنجليزيّة: Mole) بأنّه كميّة المادّة التي تحتوي عدداً مقداره 6.02×10^23 من الجزيئات أو الذرّات، ويُطلَق على هذا المقدار اسم عدد أفوجادرو ؛ نسبةً إلى العالم الإيطاليّ أميدو أفوجادرو، كما يساوي المول عدد الذرّات أو الجزيئات الموجودة في اثني عشر غراماً من ذرّة نظير الكربون 12، وتُحسب قيمته كما يأتي:[٥]
- عدد المولات=عدد الذرّات/عدد أفوغادرو
أو عدد المولات=الكتلة/الكتلة الموليّة
قياس الكتلة الموليّة
الكتلة الموليّة (بالإنجليزيّة:Molar Mass) هي كتلة الجسيمات الموجودة في مولٍ واحدٍ من المادّة؛ فمول واحد من الحديد هو مول واحد من الذّهب، فإذا تكوّنت المادّة من ذرّاتٍ؛ فالكتلة الموليّة هي كتلة الذرّات بالغرام في مولٍ واحدٍ منها، أمّا إذا تكوّنت من جزيئات؛ فتُحسَب كتلة الذرّات المختلفة المكوّنة للجزيء الموجودة في مولٍ واحدٍ منه بالغرام، وتُحسَب الكتلة الموليّة باستخدام القانون الآتي:[٥]
- الكتلة الموليّة = الكتلة/عدد المولات
الجدول الدوريّ للعناصر
يوجد في الكيمياء ما يُسمّى بالجدول الدوريّ للعناصر ، وهو خلاصة العدد الذريّ والكتليّ للعناصر المُكتشَفة في الطّبيعة، ويتكوّن من 18عموداً؛ يُسمّى كلّ منها مجموعةً، و7 صفوفٍ أفقيّةٍ تُسمّى دوراتٍ؛ حيث تُجمَع العناصر المتشابهة في الصّفات الفيزيائيّة والكيميائيّة في المجموعة نفسها. تُقسَم مناطق الجدول الدوريّ قسمَين: قسم يحوي العناصر الممثّلة (A)، وقسم يحوي العناصر الانتقاليّة (B).[٥]
أمثلة على قياس المادّة
- مثال (1):جد كتلة جسمٍ وزنه 14 نيوتن.
- الحلّ:
- الكتلة=الوزن/تسارع الجاذبيّة الأرضيّة
- الكتلة=9.8/14
- الكتلة=1.428كغ
- مثال (2):جد كثافة جسم كتلته 20كغ، وحجمه 4 لتراتٍ.
- الحلّ:
- الكثافة=الكتلة/الحجم
- الكثافة=4/20
- الكثافة=5كغ/لتر
- مثال (3):جد كتلة ذرّةٍ واحدةٍ من الفضّة بوحدة الغرام.
- الحلّ:
- بالرّجوع إلى الجدول الذريّ للعناصر، فإنّ كتلة عنصر الفضّة هي 107.9غ
- ومن المعلوم أنّ 1 مول من الفضّة يحتوي 6.02×10^23 من الذرّات، إذاً:
- عدد المولات=عدد الجسيمات/عدد أفوغادرو
- عدد المولات=6.02/1×10^23
- عدد المولات=1.66×10^-24
- عدد المولات=الكتلة/الكتلة الموليّة
- الكتلة=عدد المولات×الكتلة الموليّة
- الكتلة=1.66×10^-24×107.9
- الكتلة=1.791×10^-24غ
المراجع
- 1 - Lynnette Brent "States of Matter" , Canada: Crabtree Publishing Company , 2009 , (Page 4. Edited) .
- 2 - N.K Verma "Comprehensive Science and Technology Chemistry" , New Delhi: Laxmi Publications , (Page 19. Edited) .
- 3 - Erin Sullivan "Bridges: Measuring Matter" , China: Benchmark Education , 2011 , (Page 12. Edited) .
- 4 - R Nave " Mass and Weight " .
- 5 - Raymond Chang "General Chemistry" , New York: McGraw-Hill , (Page 10. Edited) .